
Mit einem Negativ Prädiktiven Wert (NPV), Sensitivität und Spezifität von 100%, 100% und 55,2% für den Ausschluss der TVT und 99,7%, 97,0% und 75,5% für den Ausschluss der Lungenembolie, demonstriert STA®-Liatest® D-Di beste klinische Leistungsdaten als automatisierter D-Dimer Test für den Ausschluss von TVT und LE.
Die umfassende, prospektive Studie wurde unter strengen Auflagen und unter Beachtung der CLSI Richtlinie H59-A (Quantitative D-Dimer for the exclusion of venous thromboembolic disease, approved guideline 2011) durchgeführt.
Seit mehr als 15 Jahren ist STA®-Liatest® D-Di der Standard für die Versorgung tausender Krankenhäuser, medizinischer Zentren und privater Labore mit einem quantitativen, automatisierten D-Dimer Test. Über 2 Millionen Patientenergebnisse werden weltweit erstellt. D-Dimer Ergebnisse sind kritisch für die diagnostischen Algorithmen zum Ausschluss der TVT bei niedriger und moderat erhöhter Prätest-Wahrscheinlichkeit. Die Anwendung von D-Dimer Ergebnissen bei Patienten mit Verdacht auf tiefe Venenthrombose (TVT) wird in der CLSI Richtlinie H59-A (Quantitative D-Dimer for the exclusion of venous thromboembolic disease, approved guideline 2011) aufgeführt. Um die klinische Leistung und Erfüllung der strengen Anforderungen der CLSI Richtlinie zu demonstrieren, hat Stago eine fünfjährige, multinationale, prospektive Studie durchgeführt. Diese DiET Studie wurde bei den US National Institutes of Health (NCT01221805) registriert und beinhaltet die Prätest-Wahrscheinlichkeitsbewertung, Ergebnisse objektiver bildgebender Verfahren und eine dreimonatige Nachverfolgung der Patienten.
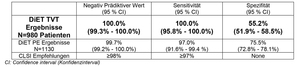
Mehr als 2.000 ambulante Patienten mit Verdacht auf TVT oder LE wurden weltweit an 16 Instituten in die DiET Studie eingeschlossen: United States (9), Frankreich (2), Italien (2) und Spanien (2). Die Ergebnisse übertrafen die Leistungsziele der FDA und CLSI für Sensitivität und Spezifität, der zwei meist relevanten Kriterien zum Ausschluss der TVT und LE bei Patienten mit niedriger oder moderater Prä-Testwahrscheinlichkeit, wie in der CLSI Richtlinie H59A gefordert.
STA®-Liatest® D-Di bewies weiterhin die beste klinische Spezifität in der DiET Studie. Eine höhere Spezifität bedeutet weniger falsch positive D-Dimer Ergebnisse und weniger unnötige Überweisungen für bildgebende Verfahren, welche kostenintensiv für das Gesundheitssystem sind, die Liegezeiten verlängern und die Strahlenbelastung der Patienten, sowie die damit verbundenen Komplikationen durch bildgebenden Untersuchungen erhöhen.
STA®-Liatest® D-Di und STA®-Liatest® D-Di Plus bieten zuverlässige, vollautomatisierte, gebrauchsfertige Testsysteme mit „Best-in-Class-Effizienz“ von 15 Tagen on-board-Stabilität, neue flüssige Kontrollen mit 72 Stunden on-board-Stabilität und Ergebnisse in 8 Minuten.


